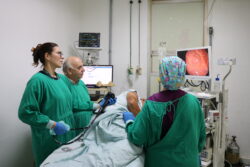
O Hospital de Clínicas da Universidade Estadual de Campinas – Unicamp começou nesta quinta-feira (06-08), os testes clínicos da vacina contra o coronavírus, que são conduzidos pelo Instituto Butantan em parceria com a farmacêutica chinesa Sinovac Life Science, parte do grupo Sinovac Biotech. O primeiro voluntário a receber a vacina foi um médico residente da FCM, 29 anos e que faz parte de um grupo de 500 candidatos selecionados das áreas COVID-19 do hospital.
O hospital é o segundo centro de estudo no interior de São Paulo a iniciar os testes da CoronaVac no Brasil. O momento histórico contou com a presença do reitor da Unicamp, Marcelo Knobel, do diretor executivo da área da Saúde da Unicamp, Manoel Barros Bertolo, do superintendente do HC Antonio Gonçalves de Oliveira Filho e de toda equipe envolvida no projeto, inclusive uma gerente de pesquisa do Butantan.
Além de Campinas outros cinco centros de pesquisa iniciam a testagem da vacina contra covid-19 em voluntários ainda nesta semana. Ao todo, são 12 os centros selecionados para a realização da terceira e última fase de ensaios clínicos do imunizante que é desenvolvido pelo Instituto Butantan em parceria com a farmacêutica chinesa Sinovac Life Science. Outros seis já estão em operação.
Os voluntários para o teste da vacina não podem ter sofrido infecção provocada pelo novo coronavírus, nem ter participado de outros estudos. As mulheres não podem estar grávidas ou estarem planejando uma gravidez nos próximos três meses. Outra restrição é não ter doenças instáveis ou que precisem de medicações que alterem a resposta imune.
Entre os recrutados, metade receberá duas doses do imunizante num intervalo de 14 dias e a outra metade receberá duas doses de placebo, uma substância com as mesmas características, mas sem os vírus, ou seja, sem efeito. Essas pessoas serão monitoradas pelos centros de pesquisa por meio de exames entre aqueles que tiverem sintomas compatíveis à COVID-19.
“Estamos subindo mais um degrau a caminho de uma vacina. Os resultados preliminares dos estudos clínicos de fase I e II na China são muito animadores e estamos confiantes que vamos recrutar o número de voluntários necessários o mais rápido possível para conseguir dados suficientes que possam comprovar a eficácia e a segurança da vacina e, assim, submetê-la para registro da Anvisa”, afirma o diretor de Pesquisas Clínicas do Instituto Butantan, Ricardo Palacios.
O coordenador do projeto no HC da Unicamp, Francisco Aoki, explica que todos candidatos serão acompanhados durante um ano no hospital por uma equipe multidisciplinar que envolve médicos, enfermeiros e farmacêuticos. “Com isso comprovamos posteriormente se quem tomou a vacina ficou de fato protegido em comparação a quem tomou o placebo”, diz Aoki.
O primeiro centro a testar a Coronavac em voluntários foi o HC da Faculdade de Medicina da USP, na capital, no dia 21 de julho. O imunizante desenvolvido pela Sinovac Life Science é um dos mais promissores do mundo porque utiliza tecnologia já conhecida e amplamente aplicada em outras vacinas.
O laboratório asiático já realizou testes em cerca de mil voluntários na China, nas fases 1 e 2. Antes, o modelo experimental aplicado em macacos apresentou resultados expressivos em termos de resposta imune contra o coronavírus. Os testes da fase 3, realizados em 9 mil voluntários pelo país, devem ser concluídos em outubro.
A testagem, coordenada pelo Butantan, deve ser concluída entre o final de outubro e o início de novembro com cerca de 9 mil voluntários. O Hospital das Clínicas da Faculdade de Medicina da USP (HCFMUSP) foi o primeiro a aplicar a CoronaVac, no dia 21 de julho. No complexo do HC.
Na semana passada, entre quinta (30) e sexta-feira (31), os testes começaram no Instituto de Infectologia Emílio Ribas, na Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Universidade Municipal de São Caetano do Sul e no Centro de Pesquisa e Desenvolvimento de Fármacos da UFMG (Universidade Federal de Minas Gerais).
A Sinovac forneceu ao Butantan as doses da vacina para a realização dos testes clínicos de fase III em voluntários no Brasil, com o objetivo de demonstrar sua eficácia e segurança. As fases I e II de ensaios clínicos foram realizadas com cerca de 700 voluntários na China com bons resultados preliminares. Antes, o modelo experimental aplicado em macacos apresentou resultados expressivos em termos de resposta imune contra o coronavírus.
Assim que forem comprovadas a eficácia e a segurança nesta última fase de estudos clínicos e a vacina seguir para registro da Agência Nacional de Vigilância Sanitária (Anvisa), a Sinovac e o Butantan vão firmar acordo de transferência de tecnologia para produção em escala e fornecimento gratuito pelo SUS.
Abaixo, a relação dos 12 centros de estudo que vão participar da fase final de pesquisa da vacina contra o coronavírus:
- Hospital das Clínicas da Faculdade de Medicina da USP
- Hospital de Clínicas da Unicamp
- Instituto de Infectologia Emílio Ribas
- Hospital das Clínicas da Faculdade de Medicina da USP de Ribeirão Preto
- Universidade Municipal de São Caetano do Sul
- Universidade Federal de Minas Gerais
- Hospital Israelita Albert Einstein
- Hospital das Clínicas da Universidade Federal do Paraná
- Faculdade de Medicina de São José do Rio Preto
- Universidade de Brasília
- Instituto Nacional de Infectologia Evandro Chagas de Fiocruz (RJ)
- Hospital São Lucas da PUC do Rio Grande do Sul
Caius Lucilius – Assessoria de Imprensa HC
com Assessoria de Imprensa do Instituto Butantan